採択課題
標的細胞選択性を有する肝硬変治療用細胞外分泌小胞の開発
研究開発代表者
柳川 享世
東海大学

1. 細胞外小胞
細胞外小胞とは、文字通り、細胞の外に分泌される直径100 nm前後の小胞である(図1)。生体のあらゆる種類の細胞から分泌され、血液や涙、尿など様々な体液中に存在する。血液中を循環する細胞外小胞は遠位の臓器や細胞まで到達することも可能であり、臓器間や細胞間のコミュニケーション手段の一つと考えられている。細胞外小胞は脂質二重膜で構成され、内腔には分泌元の細胞由来の核酸、タンパク質などの物質を含む(図2)。この内包された成分や細胞外小胞を構成する膜の脂質がメッセンジャーの役割を果たし、細胞外小胞を取り込んだ標的細胞に作用する。近年では動物のみならず、植物や微生物もそれぞれ特有の細胞外小胞を分泌することが明らかになってきた。

図1:血液から精製した細胞外小胞
透過型電子顕微鏡にて撮影(5,000倍)
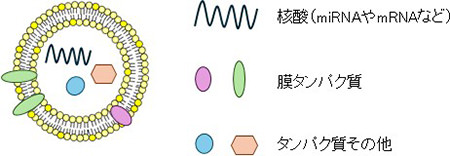
図2:細胞外小胞の模式図(研究代表者作成)
2. 細胞外小胞の臨床応用
細胞外小胞の臨床応用は、診断への利用と治療薬としての利用という2つの側面から研究が進められている(図3)。細胞外小胞に内包される核酸成分の中でも、特にマイクロRNA(miRNA)を解析することで、癌やその他の疾患特有のmiRNA構成を突き止め、尿や少量の血液といった侵襲性の低い検体から早期の疾患を検出することが期待されている。また、内包されるmiRNAの一部は治療効果を有することも明らかになってきており、培養細胞の上清から有効なmiRNAを含む細胞外小胞を回収して治療薬として利用する研究も盛んである。この方法は、産生細胞が分泌した細胞外小胞をそのまま利用することから、天然型と呼ばれる。
今後は、細胞外小胞が薬効成分を含むように培養細胞を加工したり、後天的に薬効成分を内包させたりして、薬物送達系のキャリアーとして利用する研究が増加すると予想されている。これらの細胞外小胞は、前述の天然型に対して加工型(Engineered)と呼ばれる。
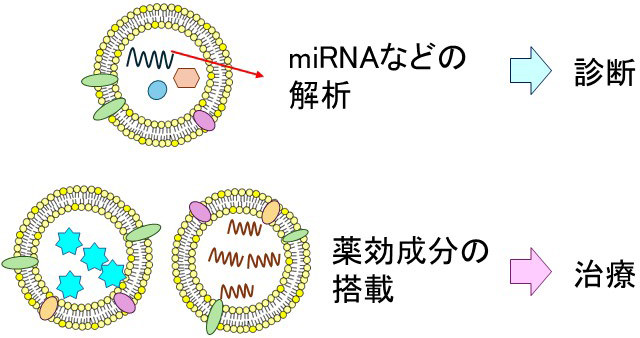
図3:細胞外小胞の臨床応用イメージ(研究代表者作成)
3. 細胞種選択的送達の重要性
一般的に、細胞外小胞を外来的に投与すると、数十分程度で異物の貪食細胞であるマクロファージに取り込まれて処分されることが明らかになっている。したがって、治療薬として細胞外小胞を利用する際には、マクロファージの貪食を回避する工夫が必要となる。また、薬効成分を含有させた治療薬としての細胞外小胞が標的以外の細胞に多く取り込まれてしまうと、主作用の低減や副作用の出現が懸念される。そのため、標的細胞だけに選択的に送達し、取り込ませることが重要である。例として、リガンド-受容体の関係を利用したり、電荷を変化させて細胞表面に留まりやすくするような加工が試行されている。
4. 肝硬変、肝線維症と肝再生
肝硬変は、肝線維症の終末像である。肝線維症は、肝臓の慢性的な炎症により、肝星細胞と呼ばれる細胞が活性化してコラーゲン線維を盛んに産生するようになり、これが徐々に肝組織に蓄積することにより進展する(図4)。慢性炎症の原因は、肝炎ウイルスへの感染や高脂肪食、アルコールの多飲など様々である。近年ではアルコール摂取の有無にかかわらず、脂質異常や糖代謝異常などを背景とした代謝機能障害関連脂肪肝炎(MASH)とその進行に伴う肝線維症が増加しており、世界的にも肝疾患領域の重要な克服すべき課題となっている。日本においても成人の3~4人に1人は脂肪肝と推定され、そのうち2~3割はMASHへと進行する。肝硬変の患者数は年間50万人程度であり、肝硬変に至ると肝細胞癌を発症しやすくなり、その患者数は年間7万人に達する。
肝臓は本来とても再生能力の高い臓器であり、生体肝移植のドナー肝が半年から1年程度で元の容積まで回復することがそれを端的に示している。一方で、肝線維症が進行すると再生能力が徐々に失われ、肝硬変に至ると再生不全に陥る。2000年代までは肝硬変は不可逆的な病態であると考えられてきたが、近年では原因治療が奏功すれば自然に回復することが知られるようになった。
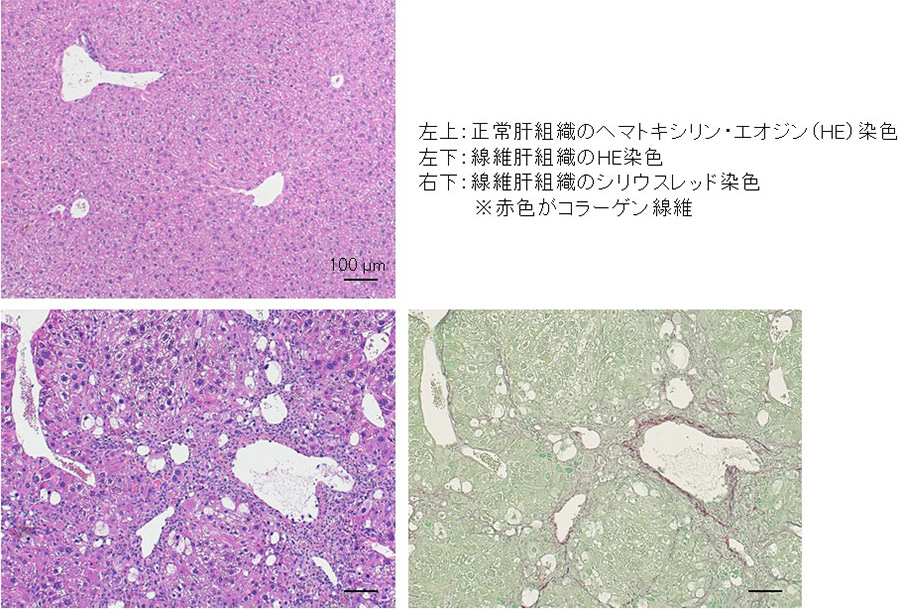
図4:マウスの正常と四塩化炭素反復投与による肝線維症モデルの肝組織
5. 本研究開発課題で目指すこと
本研究開発課題では、研究代表者の所属研究室にて独自に見出した肝再生促進因子を薬効成分として搭載し、さらに表面を加工することにより、標的である肝実質細胞へ選択的に送達される肝硬変用治療薬としての細胞外小胞を開発する。
外来的に投与された細胞外小胞の大部分は肺や肝臓に集積することが知られている(図5左)。しかしながら、一言で「肝臓」といっても複数種類の細胞から構成されており、数として約8割を占める肝実質細胞への取り込みはわずかである。肝臓の内在性マクロファージであるKupffer細胞がその殆どを取り込んでいるため(図5右)、治療用細胞外小胞の開発にあたっては、標的である肝実質細胞への選択的な送達の実現を目指す。

図5:投与した細胞外小胞の肝臓への蓄積(左)と肝組織内における局在(右)