採択課題
スプライシング異常を標的とした新規がん治療の研究開発
研究開発代表者
小林 祥久
国立がん研究センター

発がん遺伝子であるRASファミリー(KRAS/NRAS/HRAS)は、がん種を問わず全がんの約3割で変異している。蛋白質構造の特性により薬剤との結合部位の探索が難しく長年創薬開発が困難であったが、近年KRAS G12C変異蛋白質を標的とする低分子化合物の開発および肺がん・大腸がんに対する実用化に成功したことを皮切りに、複数のKRAS変異に有効なpan-KRAS阻害剤を含む有望な薬剤が次々と開発されている。しかし、その有効性は限定的であり必ず耐性を獲得してしまうため、がんの根治を目指すには新たな創薬機序に基づく治療薬開発が必要である。
代表者は肺がんの薬剤耐性機序の解明に従事する中で、ゲノム編集細胞モデルにおいて「発がん性が確立しているKRAS Q61K変異が、なぜか耐性を示さない」という実験データに着目した。その機序を精査したところ、RASファミリーに共通して、
①Q61周囲にスプライシング制御因子Exonic Splicing Enhancer (ESE)が集中していること
②Q61周囲の変異によりESEが壊れると正常なスプライシングが機能せず発がん性Q61変異蛋白質が作られないこと
が判明した。そこで、②の機序を利用して、RAS Q61変異特異的なESE配列のpre-mRNAを標的とした核酸医薬でESEを無効化したところ、細胞・マウス実験でがん細胞選択的にスプライシング異常を誘導して細胞死を誘導できることを確認した (図1. Nature 2022)。
Q61変異は、KRASではG12・G13に次いで多く、NRASとHRASでは最も頻度が高いため、潜在的な対象患者数は日本で年間約5万人と推測される (図2)。
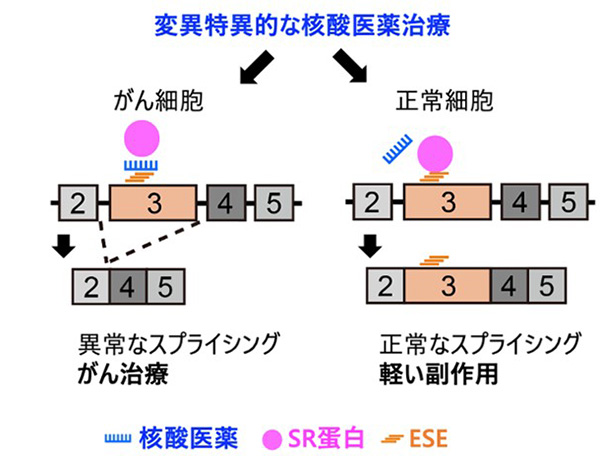
図1:がん細胞だけを攻撃する変異特異的な核酸医薬治療
がん細胞の発がん遺伝子変異部位を含むスプライシング制御因子ESEを標的として核酸医薬を設計することで、がん細胞では異常なスプライシングを誘導して自滅させる。一方、正常細胞の野生型のESEには結合しないため、軽い副作用が期待できる。
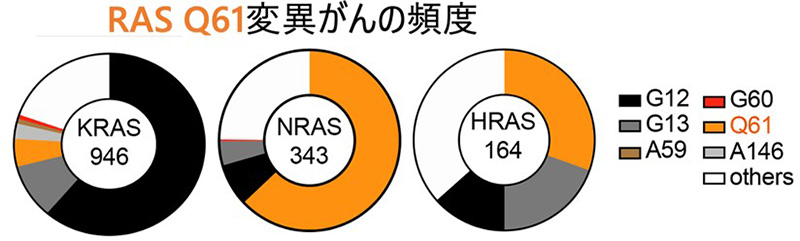
図2:KRAS、NRAS、HRASにおけるQ61変異の頻度
スプライシング制御型核酸医薬の有用性は神経・筋疾患領域で実証されているが、がん領域で承認されたものはない。そこで本研究では、大規模ゲノムデータ解析の白石分野長、プロテアーゼ型CRISPR-Cas酵素(Cas7-11)を発見した加藤准教授、橋渡し研究推進センターの都賀拠点統括とチームを結成して、以下のリサーチクエッションに取り組む。
①RAS Q61以外にも本研究コンセプトに最適な標的候補遺伝子はないか?
②がん細胞に対する治療効果をどのように増強できるか?
「ESEを標的とした核酸医薬によるがん治療の開発」はpre-mRNA配列を標的とするため、発がん蛋白質そのものを治療標的とすることが困難ながん種も含め、がん種を問わず治療できる汎用性が期待できる。