採択課題
新規高機能スプライシング制御オリゴヌクレオチドをもちいた糖原病Ia型本邦好発変異に対する新規治療法開発
研究開発代表者
岡田 賢
広島大学

近年、スプライシング制御核酸(Splice Switching Oligonucleotide:SSO)の開発が進み、革新的な治療法として注目を集めています。しかし、標的細胞において十分な効果を発揮するSSOを実現するには、いくつかの技術的課題が残されています。SSOは、細胞内への取り込みや核内への移行を促進するために短鎖化が求められる一方で、標的RNAとの高い結合性を確保するためには長鎖化が有利であり、この相反する要件を両立させる必要があります。さらに、標的組織へ十分な量のSSOを効率的に送達する技術も不可欠です。
今回、私たちは企業との共同開発により、相補的RNAに対する高い結合能と優れた生体内安定性を併せ持つ修飾核酸「2′-O,4′-C-ethylene-bridged nucleic acids(ENA)」を用いた短鎖SSO(15mer)の設計に成功しました。さらに、GalNAc修飾体を組み合わせることで、肝臓において強力かつ持続的なスプライシング制御を可能とする、高機能SSO技術を確立しました(図1)。
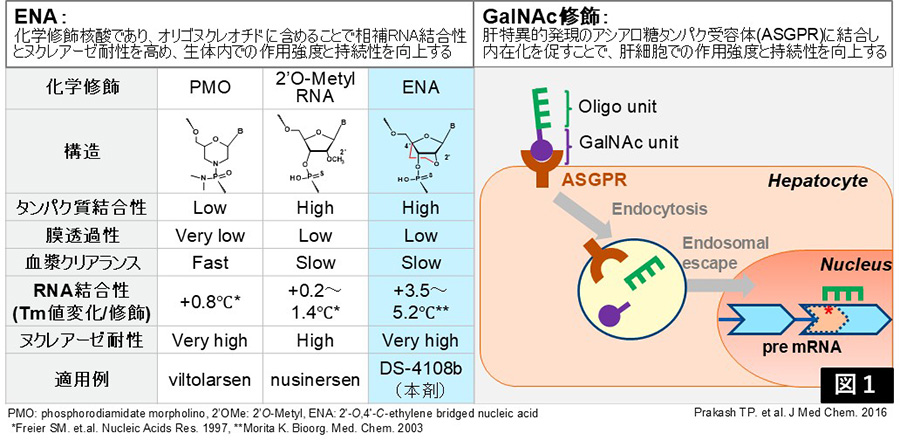
図1:ENAとGalNAc修飾を組み合わせた新規高機能SSO
私たちは、本技術を応用する最初の疾患モデルとして、糖原病Ia型における本邦好発変異を選定しました。糖原病Ia型は、グルコース-6-ホスファターゼ(G6Pase)をコードするG6PC遺伝子の機能欠損変異によって発症する、常染色体劣性遺伝形式の極めて稀な先天性代謝異常症です。本疾患では、頻回な低血糖発作と、それに伴う中枢神経障害のリスクがあるため、新生児期より厳格な血糖管理が不可欠となります。具体的には、頻繁な高炭水化物摂取を中心とした厳格な食事療法が必要であり、これは患者さんおよびそのご家族にとって大きな負担となっています。さらに、この食事療法には、グリコーゲン代謝異常によって生じる肝腫大、肝腫瘍などを根本的に予防する効果はなく、現在も根治療法は確立されていません。
そこで私たちは、東アジア地域の糖原病Ia型患者に高頻度で認められる「G6PC遺伝子c.648G>T変異」に着目しました。この変異は、スプライシング異常を介して発症に至ることが知られており、日本人患者では約91%、韓国人で約75%、中国人で約54%という高いアレル頻度が報告されています。この遺伝的背景を踏まえ、私たちは新たに開発したSSO技術をこのスプライシング異常変異に応用することで、東アジアの糖原病Ia型患者に対する革新的な治療戦略の実現を目指しています(図2)。
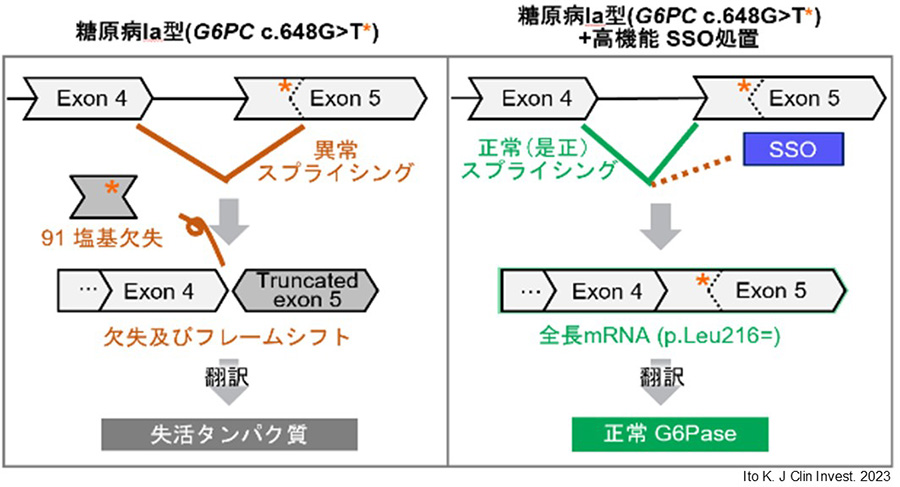
図2:日本人好発変異と高機能SSOの作用機序
これまでの研究開発において、患者由来の細胞およびc.648G>T変異をノックインした疾患モデルマウス(GSDIaモデルマウス)を用いた多角的な検証を実施し、GalNAc修飾を施した複数の高機能SSOが優れたスプライシング是正効果を発揮することを確認しました。その中から、治療薬候補として「DS-4108b」を選抜しました。このDS-4108bをGSDIaモデルマウスに投与した結果、G6Pase活性の有意な上昇が確認されました。さらに、長期投与試験では、以下のような疾患修飾効果が認められました。(図3)。
- 絶食時の低血糖の改善
- 肝臓の肥大の改善
- 肝臓内のグリコーゲンや中性脂肪の蓄積の軽減
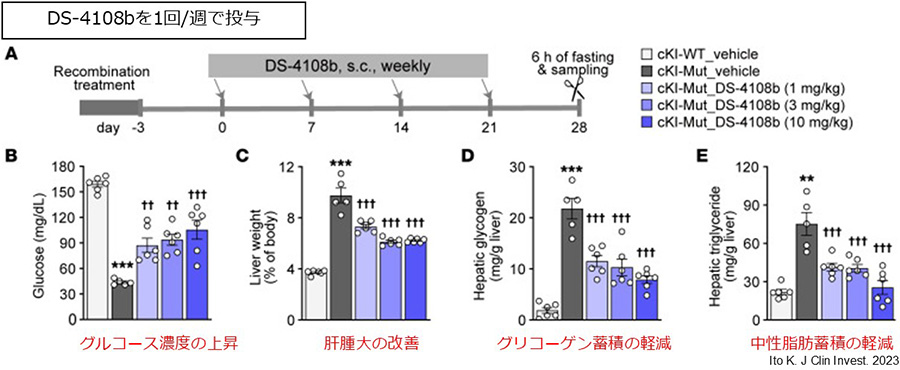
図3:疾患モデルマウスを用いたDS-4108bの有効性評価
現在、糖原病Ia型に対する核酸医薬品としては、すでに2剤が臨床試験に進んでいますが、DS-4108bは日本を含む東アジア人患者に特化して設計された新規治療薬です。
本薬剤の特長は以下の通りです:
- 血糖値に応じてG6Paseの発現を調節できる機構を備えており、長期的な血糖コントロールの安定化が期待されます。
- 肝細胞全体に取り込まれる設計により、肝腫大の改善効果も期待できます。
- 1〜2ヶ月に1回の皮下注射での投与が可能であり、患者さんへの治療負担が大きく軽減されます。
本研究では、糖原病Ia型に対する新規治療薬DS-4108bの低血糖抑制効果を臨床試験で検証し、有効性の裏付けとなるProof of Concept(POC)の取得を目指しています。現在、臨床試験の選択肢を広げるための追加安全性試験や、治験薬の製造プロセス(CMC開発)も並行して進行中です。将来的には、企業との共同開発を通じて、本剤を日本発の新たな治療選択肢として実用化し、糖原病Ia型患者さんのQOL向上と予後改善に貢献することを目指しています。