採択課題
人工ユビキチンリガーゼ補充療法のための創薬基盤構築
研究開発代表者
横尾 英知
国立医薬品食品衛生研究所 有機化学部 室長

特定のタンパク質を分解して,その機能を制御するタンパク質分解医薬品(targeted protein degradator : TPD)が革新的な医薬品として注目を集めています1).中でもProteolysis targeting chimera(PROTAC)は,近年,国内外で盛んに開発されている分子であり、がん領域を中心として,現在,約30品目の臨床試験が進められています(図)。PROTACは,これまでの低分子医薬品では狙うことが難しいと考えられていた難しいタンパク質も分解しうるため,様々な疾患へ応用できるのではないかと期待されています.また、従来の阻害剤が単にタンパク質の機能を抑制するのに対し、PROTACはタンパク質そのものを除去するため、より効果的かつ持続的な作用が期待できます。
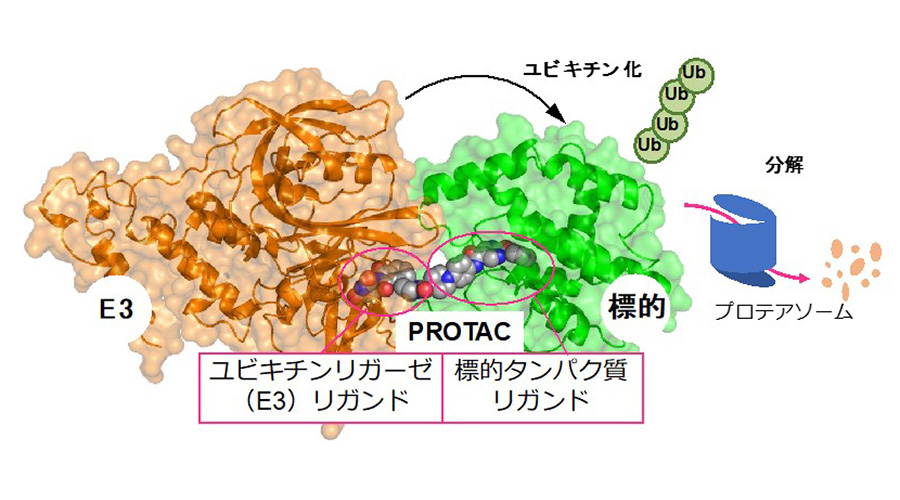
図:PROTACはユビキチンリガーゼ(E3)リガンドと標的タンパク質リガンドを組み合わせたキメラ化合物であり、PROTACがユビキチンリガーゼ(E3)および標的タンパク質に結合して三者複合体を形成し、標的タンパク質のユビキチン化およびプロテアソームを介した分解を導く
PROTACは,標的タンパク質リガンドとE3リガーゼリガンド,それらの両リガンドをつなぐリンカーから構成されるキメラ分子であり,生体内に備わるユビキチン-プロテアソームシステム(ubiquitin-proteasome system: UPS)を利用して任意のタンパク質を分解します.細胞内に到達したPROTACは標的タンパク質とE3リガーゼに結合し,三者複合体の形成,E3リガーゼによる標的タンパク質のユビキチン化およびプロテアソームによる分解を導きます.
我々はこれまで様々な標的タンパク質に対するPROTACを開発してきました2-9)。こうした研究を進める中で、生体内のユビキチンリガーゼに依存して活性が変化するというPROTACの課題を見出しました。今後、幅広い疾患に適用できる技術とするには、ユビキチンリガーゼへの依存性を抑制した技術が必要です。そこでユビキチンリガーゼを外的に補いつつ、任意のタンパク質を分解する創薬基盤技術の創出を目指しています。
こうした研究により培った基礎技術を基に本研究では、さらに高度化したタンパク質分解分子を見出します。研究の中では、最先端の構造予測技術等も組み合わせながら、効率的に見出す方法も検討します。本研究により、内在性ユビキチンリガーゼに対する依存性を克服したタンパク質分解医薬品を創出することで、様々な患者様、疾患に適用可能な技術に繋がると考えています。
関連リンク
参考論文
- Békés M., Langley D. R., Crews C. M., Nat Rev Drug Discov, 21, 181-200 (2022).
- Yokoo H., Ohoka N., Naito M., Demizu Y., Bioorg Med Chem, 28, 115595 (2020).
- Yokoo H., Shibata N., Naganuma M., Murakami Y., Fujii K., Ito T., Aritake K., Naito M., Demizu Y., ACS Med Chem Lett, 12, 236-241 (2021).
- Yokoo H., Shibata N., Endo A., Ito T., Yanase Y., Murakami Y., Fujii K., Hamamura K., Saeki Y., Naito M., Aritake K., Demizu Y., J Med Chem, 64, 15868-15882 (2021).
- Yokoo H., Ohoka N., Takyo M., Ito T., Tsuchiya K., Kurohara T., Fukuhara K., Inoue T., Naito M., Demizu Y., Int J Mol Sci, 22, (2021).
- Yokoo H., Naito M., Demizu Y., Expert Opin Drug Discov, 18, 357-361 (2023).
- Xu H., Ohoka N., Inoue T., Yokoo H., Demizu Y., Bioorg Med Chem Lett, 107, 129778 (2024).
- Yokoo H., Tsuji G., Inoue T., Naito M., Demizu Y., Ohoka N., Bioorg Chem, 145, 107204 (2024).
- Takano R., Ohoka N., Kurohara T., Arakawa N., Ohgane K., Inoue T., Yokoo H., Demizu Y., ACS Med Chem Lett, 16, 258-262 (2025).