採択課題
膵がん間質を標的とした抗体薬物複合体の研究開発
研究開発代表者
榎本 篤
名古屋大学

研究開発分担者
江﨑 寛季
BFACT株式会社
膵がんや胆管がん等に代表される難治がんの特徴の一つは、「間質」と呼ばれるがん細胞以外の領域に、時にがん細胞を上回る数のがん関連線維芽細胞(cancer-associated fibroblast:CAF)の反応性増生をみることです。この様ながんでは、CAFががん細胞胞巣を取り囲んで増生する像がみられます(図1)。CAFはコラーゲン等の細胞外基質を産生する能力に富む細胞であり、これらの細胞外基質が沈着することにより間質の線維化が誘導されます。CAFの増生や細胞外基質の沈着の程度は部位によって大きく異なっており、この腫瘍内不均一性はヒトのがんの治療を難しくさせる大きな要因の一つです。
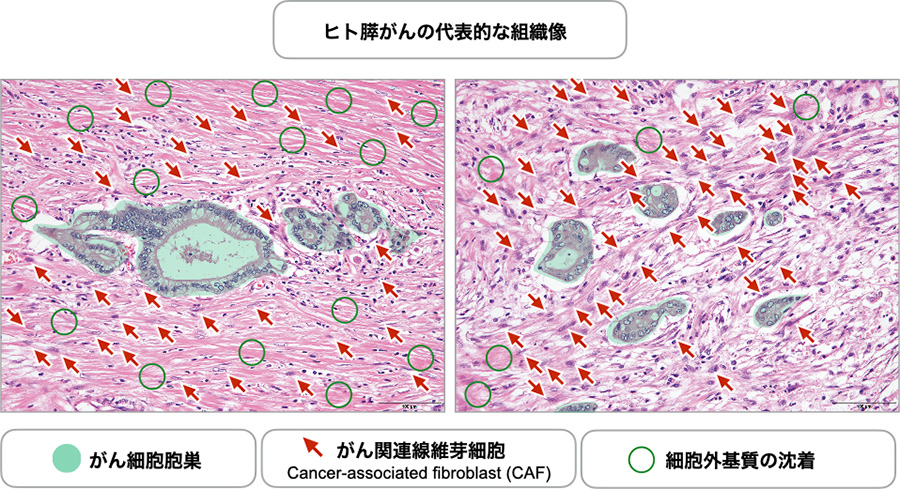
図1:ヒト膵がんにおけるCAFの増生および細胞外基質の沈着
典型的なヒト膵がん(中分化管状腺がん)の同一症例からの別々の領域の組織像を示す。がん細胞胞巣の周囲に増生するCAFの一部を赤矢印で、間質に沈着した細胞外基質(好酸性の物質)の一部を丸で示した。部位によってCAFの増生や線維化の程度が異なることが理解される(腫瘍微小環境の腫瘍内不均一性)。
線維化によるがん組織の硬化はがん細胞を活性化し、同細胞の増殖能や浸潤能を上昇させることがわかっています。さらに、がん組織の線維化および硬化は腫瘍血管の虚脱と阻血性の微小環境、ドラッグデリバリー効率の低下、免疫抑制性微小環境(immune-cold tumor)の形成を誘導することが知られています(Kobayashi et al., Nat Rev Gastroenterol Hepatol. 16(5):282-295, 2019)(図2)。
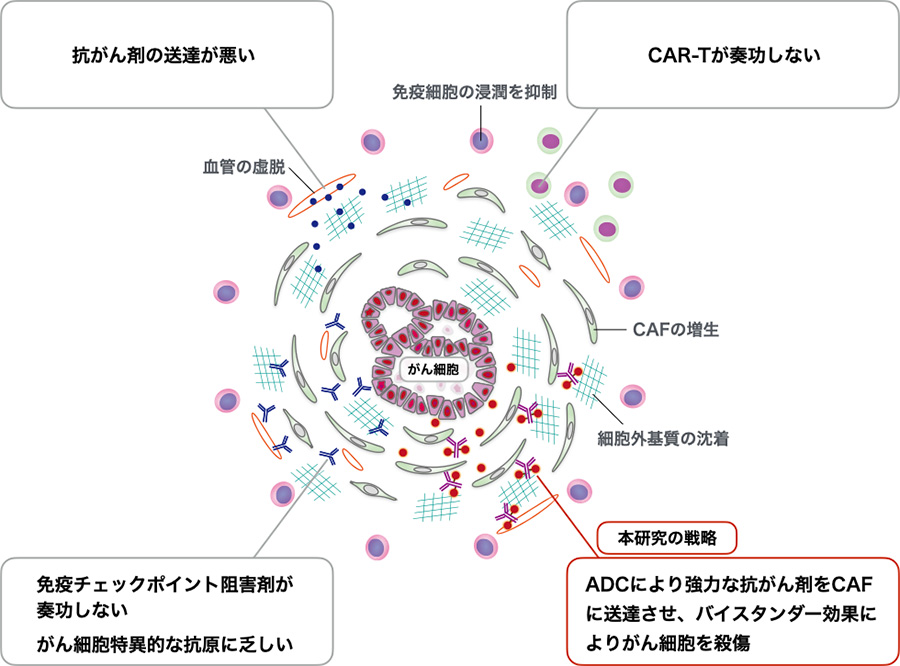
図2:CAF増生および間質線維化反応を伴うがんの特性と本研究課題の治療戦略
膵がんではCAFの反応性増生による間質線維化反応によって血管の虚脱がおこり、抗がん剤の送達が悪いこと、CAFが産生する液性因子により免疫抑制性微小環境が形成され、T細胞やCAR-T細胞の腫瘍内浸潤が抑制されること、あるいはがん細胞特異的なネオ抗原に乏しく、免疫チェックポイント阻害剤の奏効率が極めて低いことが知られている。本研究課題では、これまでの発想とは異なるCAF標的療法の開発を目指す。
過去にCAFの増生を抑制、あるいはCAFを殺傷する治療法の開発は何度も試みられましたが、治験や臨床研究はいずれも失敗しており、CAFを殺傷・抑制する戦略は再考の時期に来ているとされています。本研究課題ではこれまでの発想を変え、独自に同定したCAFマーカー分子を標的とする抗体薬物複合体(antibody-drug conjugates:ADC)により、膵がん細胞に効率的に抗がん剤をデリバリーする新規治療法の開発を目指します(図2)。
研究代表者らはCAFに最も特異的な膜分子マーカーとしてロイシンリッチリピートを細胞外ドメインに持つGPIアンカー型分子Meflin(メフリン)を2019年に同定しました(Mizutani et al., Cancer Res. 79(20):5367-5381, 2019)(図3)。遺伝子改変マウス、がん自然発症マウスモデル、ヒト病理組織検体等を用いた検証により、Meflin陽性CAFが極めて鋭敏にがん細胞周囲に集積すること、転移巣のCAFにも発現すること、他のCAFの膜マーカー分子に比して高いmRNA発現レベルを示すことを明らかにしてきました。膵がん以外にも、胆管がん、大腸がん、肺がん、乳がん、尿路上皮がん、腎がん等、間質線維化反応を伴う多くの種類のがんでCAFに特異的に発現する分子であることを確認しています。Meflinは正常の組織の間質細胞にも発現していますが、その発現レベルは極めて弱いことを確認しています(図3)。
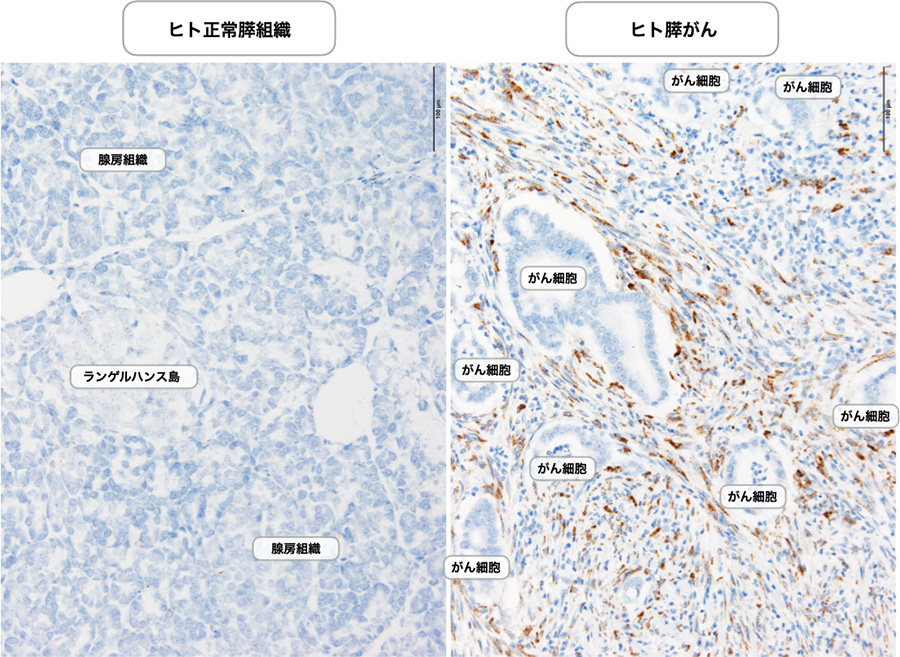
図3 ヒト膵がんCAFにおけるMeflinの発現
ヒト正常膵(左)およびヒト膵がん(右)におけるMeflin mRNAの発現をin situ hybridization法で検出した。Meflinががん細胞胞巣の周囲を取り囲んで増生するCAFに発現する像が観察される。Meflinは正常膵の線維芽細胞(膵星細胞)にも発現するが、その発現レベルは極めて低いことが確認されている。
研究開発代表者と分担者は、これまでに抗Meflinモノクローナル抗体を多数取得し、これらの抗体にリンカーを介してペイロード(MMAE等の抗がん剤)を付加したADC(以下:抗Meflin-ADC)を作製しました。これまでに複数の担がんマウスモデルで抗Meflin-ADCが顕著な抗腫瘍効果を示すことを見出しています(WO2021157601A1、日本、米国、欧州、中国、カナダ、オーストラリアへ各国移行済み)。
抗Meflin-ADCの薬効機序は、CAF細胞内に取り組まれた後に、タンパク質分解酵素によりADCからリリースされたペイロードがMultidrug resistance protein 1(MDR1)等の薬物エクスポーター(排出輸送体)によって細胞外に排出され、そのペイロードが近傍のがん細胞を殺傷する「バイスタンダー(Bystander)効果」であることが期待されます(江﨑, ファインケミカルシリーズ 抗体薬物複合体(ADC)の設計・合成と最新動向, 監修:真鍋史乃, p83-89, 2024)(図4)。この時にCAFは殺傷されないことを、培養細胞を用いた実験系で確認しています。
以上の検証結果をもとに、本研究開発では、既存の殺細胞性抗がん剤に対する抗Meflin-ADC療法の優位性、およびバイスタンダー効果の詳細な薬理機構の検証を行い、GMPグレードのADCを用いた安全性試験の実施、および切除不能進行性膵がんの患者を対象とした第I相臨床試験を開始することを目標とします。
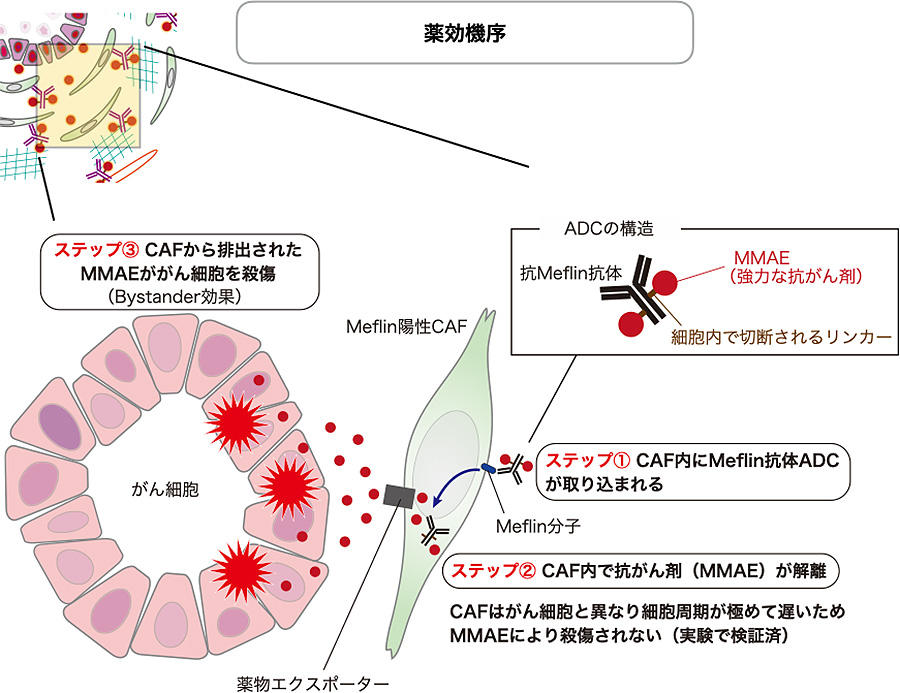
図4:抗Meflin-ADCの薬効機序
本研究課題で開発を目指す抗Meflin-ADCの薬効機序を模式的に示す。抗Meflin-ADCがMeflin陽性CAFに取り込まれた後に、CAF内でリリースされたペイロードが細胞外に排出され周囲のがん細胞を殺傷する(バイスタンダー効果)。
Meflin陽性CAFは間質線維化反応を伴うほとんどのがんで観察されることが確認されています。また、抗がん治療による選択圧や経時的進行にともなって次々と治療抵抗性を獲得あるいは遺伝子変異を蓄積するがん細胞と異なり、CAFの形質は安定であることが知られています。将来的には、抗Meflin-ADCがこれらの多種のがん、あるいは他の治療薬に対して抵抗性を獲得したがんに広く応用される日が来ることを期待しています。