採択課題
デザイナーエクソソームによるアクティブターゲティング法の開発
研究開発代表者
華山 力成
金沢大学

近年、新たな創薬モダリティとしてエクソソームが注目を集めています。エクソソームは、直径約100nmの小胞であり、分泌細胞由来の蛋白質やRNAを標的細胞に運ぶことによって、生体内の様々な生理的応答を調節する天然のデリバリーシステムとして認識されています。特に、間葉系幹細胞(MSC)由来のエクソソームを用いた臨床治験が、世界各国で進行中です。
私たちは、これまで「人工エクソソームを用いた革新的免疫制御法の開発」に取り組み、エクソソームマーカー分子テトラスパニンとのキメラ分子作製技術を駆使して、複数の免疫制御分子をエクソソーム上で同時に発現させることに成功しました。これにより、生体内で抗原特異的な免疫応答を誘導するデザイナーエクソソーム(AP-EV)の開発を進めています(WO/2021/172595、各国で移行中)。特に、CD8+T細胞(CTL)の活性化に必要な3つのシグナル(抗原ペプチド-MHCクラスI複合体、T細胞活性化補助シグナルCD80、T細胞増殖因子IL-2)を同時発現するAP-EV(CTL)が、担癌マウスにおいて内因性がん抗原特異的CD8+T細胞を活性化し、強力な抗腫瘍効果を示すことに成功しました(図1(A)、(B))。さらに、AP-EV(CTL)は腫瘍部位に持続的に集積し、腫瘍浸潤リンパ球(TIL)に「直接作用」して活性化することも明らかとなっています(図2)(J Extracell Vesicles, in press)。
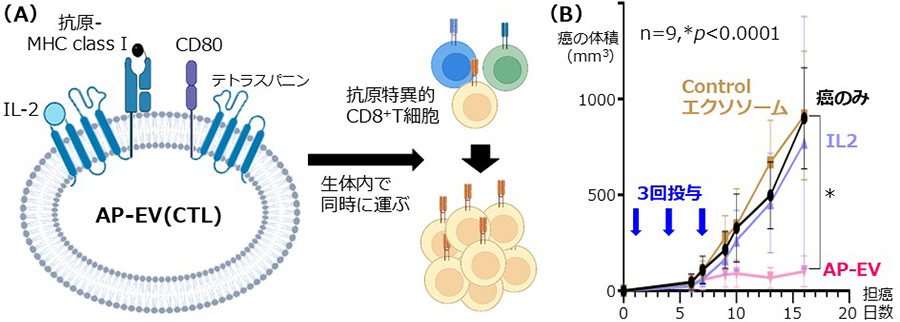
図1.AP-EV(CTL)によるがん抗原特異的CD8+T細胞の選択的活性化と抗腫瘍効果
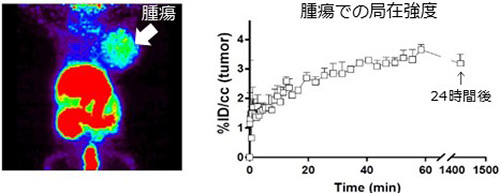
図2.静脈内投与24時間後のAP-EV(CTL)の体内局在
そこで本研究では、エクソソームによる新規モダリティの更なる高機能化を目指し、「抗原特異的免疫制御技術」に加え、「mRNA送達技術」を組み合わせることによって、生体内で抗原特異的免疫細胞を選択的に制御する世界初のアクティブターゲティング技術の開発を進めています(図3)。具体的には、細胞傷害性T細胞による抗腫瘍効果を飛躍的に向上させるエクソソームや、自己反応性B細胞を確実に除去するエクソソームの開発を進めています。また、国内企業、国立がん研究センター、国立医薬品食品衛生研究所などと連携し、高機能かつ安全性の高いエクソソーム製剤の大量生産体制と品質管理体制を確立し、臨床ステージへの進展を目指しています。この取り組みにより、難治性がんや希少疾患などのアンメットメディカルニーズに対応した効果的で副作用の少ない、日本発のエクソソーム創薬が推進されます。
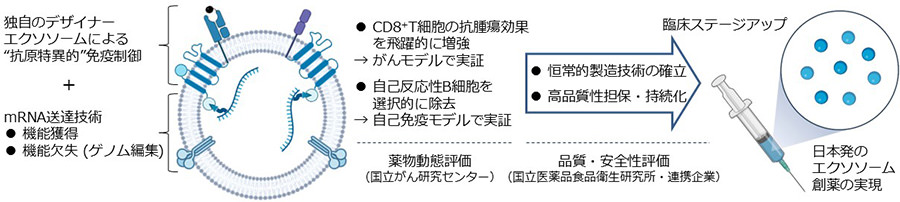
図3.「抗原特異的免疫制御」+「mRNA送達技術」による革新的アクティブターゲティング法の開発
抗原特異的免疫療法は、ペプチドワクチンや脂質ナノ粒子(LNP)を用いた開発が世界中で競争していますが、エクソソームは細胞由来の成分であり「高い安全性」を持ち、目的の免疫細胞に「直接作用」することで効率的な活性化が可能である点で優れた利点があります。さらに、本技術は改変が容易であり、積載する抗原を変えることで、あらゆる疾患への適用が期待できます。この技術を基にした予防・治療法の開発が今後進展すると考えられます。代表者はPMDAの科学委員会エクソソーム専門部会で副部会長を務め、「エクソソーム製剤に関する報告書」を通じて問題点や対応策を取りまとめてきました。また、金沢大学および連携企業の支援を受け、開発の中核となるスタートアップ企業設立の計画も進行中です。これらを通じて、Made in Japanによるイノベーションの創出に貢献し、世界のエクソソーム創薬の最前線を牽引することを目指しています。