採択課題
ウイルスベクターの基盤技術複合による革新的がん治療モダリティの高機能化開発
研究開発代表者
藤堂 具紀
東京大学

がんの死亡率は増加の一途を辿り、新しい治療法のニーズは益々高くなっています。本研究はウイルスベクターを用いる2つの基盤技術を複合し、革新的がん治療モダリティの創生と高機能化を目指します。1つ目の基盤技術は、複製可能ウイルスによる直接的ながん細胞破壊を利用する「ウイルス療法」です(図1)。がん細胞は、共通してウイルス感染に対する防御機構を欠落するため、元来がん細胞でのウイルス複製は増幅されます。しかし、がん細胞で選択的に複製し正常細胞では全く複製しないウイルスを作製するには、ウイルスゲノムを綿密に設計し、遺伝子工学的に精密にウイルスを創造する高度な基盤技術が必要です。がん細胞選択的なウイルス複製は、直接的な殺細胞効果のみならず、ウイルスが破壊したがん細胞とともに免疫に排除される過程で特異的抗がん免疫を惹起します。
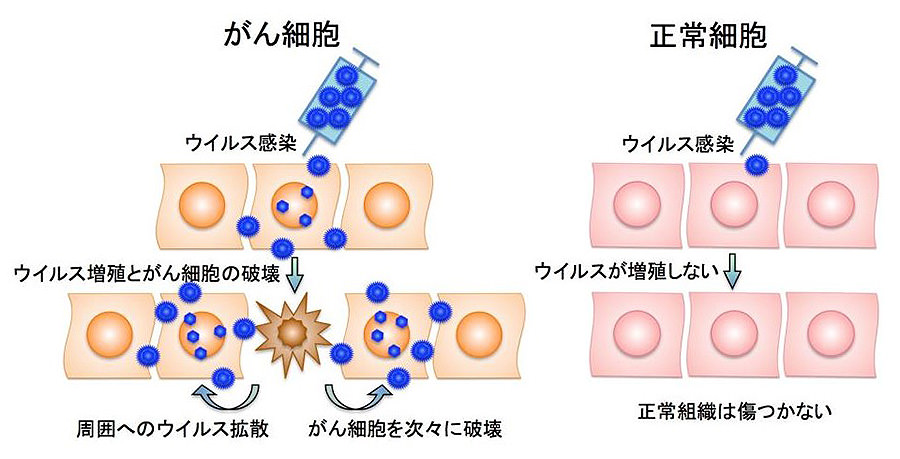
図1:がんのウイルス療法の概念図
ウイルス療法は次の2段階で抗腫瘍効果を発揮する:
(1)がん細胞で増えながらがん細胞を破壊する直接的破壊(早期作用)
(2)がん細胞に対する免疫ができて免疫ががん細胞を攻撃する抗がん免疫(後期作用)
2つ目の基盤技術は、ウイルスベクターを用いて治療遺伝子を体内のがん細胞に導入して発現させる「in vivo遺伝子治療」です(図2)。がんに対するin vivo遺伝子治療は、自殺遺伝子や血管新生阻害遺伝子など多様な治療遺伝子が試みられてきましたが、ウイルス療法技術との複合の観点からは、特異的抗がん免疫刺激を増強する治療遺伝子の活用が合理的です。
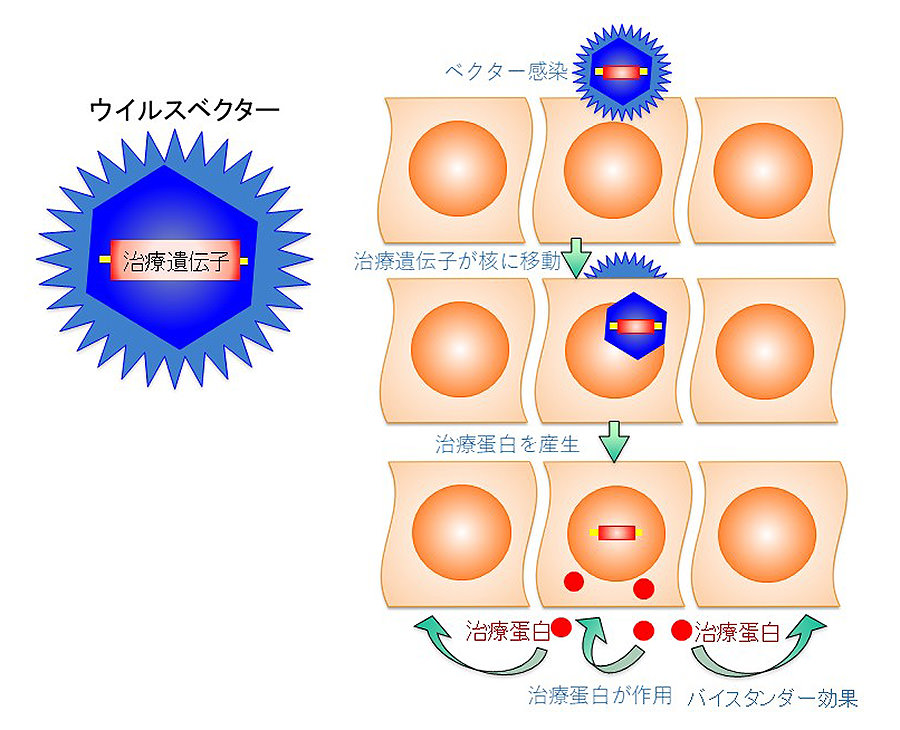
図2:In vivo遺伝子治療の概念図
ウイルスベクターを用いて治療遺伝子を細胞内に導入する。例えばHSV Ampliconを用いると細胞あたり15コピー前後の遺伝子導入が可能となる。がん細胞選択的な複製可能型HSV-1ベクターを用いると、がん細胞では、複製して新たに感染するたびに治療遺伝子が発現する。そのため、腫瘍内に治療遺伝子産物が蓄積する。
単純ヘルペスウイルス1型(HSV-1)は、ベクターとしてがん治療に有利な特長を多く有します。殊に研究開発代表者が開発した第三世代の抗がんHSV-1(G47Δ)は、人為的三重変異によって高い安全性と強力な抗腫瘍作用を同時に実現して、日本初の国産ウイルス療法製品として実用化されました。更に、G47∆の基本骨格に任意の治療遺伝子を挿入して機能型抗がんHSV-1を作製すると、複製可能型ウイルスを遺伝子デリバリーのツールとして活用できます(図3)。
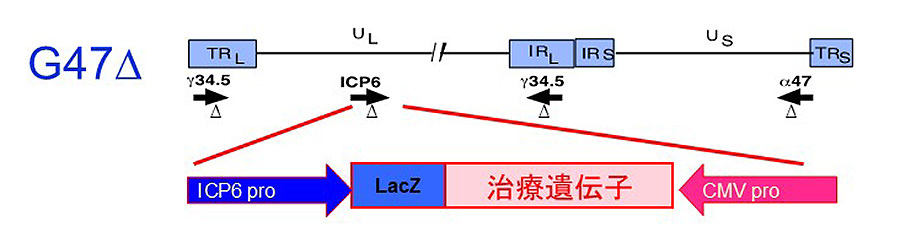
図3:G47∆を基本骨格とした治療遺伝子発現型のHSV-1ベクターの構造
第三世代がん治療用HSV-1 G47∆を遺伝子デリバリーのツールとして活用する。治療遺伝子(transgene)をG47∆ゲノムに挿入することにより、臨床安全性が実証されたG47∆に任意の抗がん機能が付加される。
治療遺伝子を運ぶウイルスベクターが、がん細胞で複製し周囲のがん細胞に感染する度に治療遺伝子が発現されるため、腫瘍内に限局して治療遺伝子産物の濃度が上がります(図4)。治療遺伝子は自由に選ぶことが可能で、また複数の機能型抗がんHSV-1を組み合わせることもできます。2つの基盤技術の複合により、治療蛋白・抗体を全身投与した場合に来す副作用を生じることなく、ウイルス療法とin vivo遺伝子治療の相乗効果が得られます。HSV-1ベクターを用いたバイオ創薬の異なる基盤技術の複合は、ウイルスを活用したがん治療を普及・発展させ、がん患者のQOL改善と治癒率向上などがん医療の革新と、新産業育成など社会経済効果が期待できます。
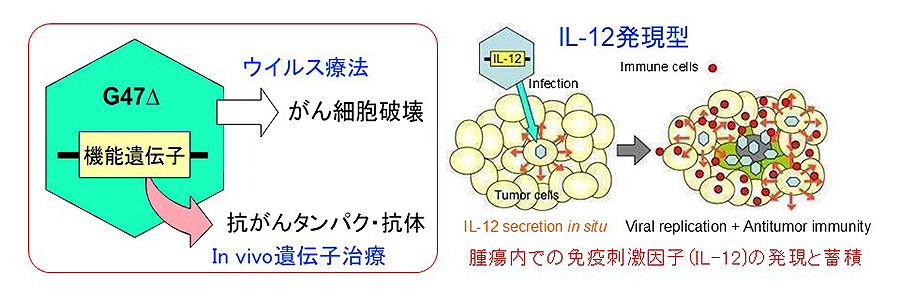
図4:2つの基盤技術の複合の概念図(左)とインターロイキン12発現型を例にした機能型抗がんHSV-1の概念図(右)
- ウイルス複製と in situでの機能遺伝子発現による相乗効果が期待できる。
- 腫瘍内に限局して挿入した外来遺伝子が発現する抗がんタンパク・抗体濃度が上昇する。抗がんタンパク・抗体の全身投与が不要となり、その副作用が回避できる。