採択課題
ホーミングペプチド搭載型次世代抗膵がんペプチド医薬の技術開発
研究開発代表者
近藤 英作
関西医科大学附属光免疫医学研究所学長特命教授

膵がんは発見時すでに転移巣を持つ進行期の患者さんが多く、またこれらの患者さんに対する決定打となる治療が未だ十分に確立していないため全がん中でも隔絶した予後不良を呈する難治癌となっています。我々は膵がんの難治性について腫瘍組織の構造学的特徴に注目し、薬剤浸透を阻む特徴的なスキルス性組織構築(著明に発達したがん線維性間質)を大きな要因の1つと考えています。本研究開発では、この線維性バリア形成による治療上の障害を克服するために、我々が確立しているランダムペプチドライブラリーをソースとした腫瘍ホーミングペプチド分離のオリジナル技術を用いて獲得した「膵がんホーミングペプチド(膵がん細胞に高度にシフトした吸収性を発揮するオリゴペプチド)」を抗がん剤キャリアとして応用し、組織浸透性に卓越した小分子型のDDS製剤(PDC; Peptide-Drug Conjugate)による新たな膵がん細胞標的治療技術の確立を進めていきます。
現在、がん医療分野では、特定のがん腫の細胞膜表面にある標的バイオマーカーの探索研究に基づいて、ドラッグデリバリーシステムの道具としてのヒト化抗体を薬剤キャリアとして用いた抗体医薬(ADC; Antibody-Drug Conjugate)の開発が活発化しています。これら抗体医薬の乳がんや胃がん、血液腫瘍などへの臨床応用が新たに展開していますが、進行期の膵がんを始めとするスキルス癌系悪性腫瘍へ適用可能なものは未だベッドサイドに登場していません。われわれの開発するホーミングペプチドを応用する「PDC」はADCの約20分の1の小サイズで、スキルス癌組織への浸透性と浸透速度はADCに優り、また構造改良が迅速に行える利点があります。さらに、キャリアとして搭載するペプチド自体がヒト化された標的用抗体と同様に生体低侵襲性で、「がん患者さんのからだにやさしい」大きな長所を持っています。我々はこれらの長所を十分に活かした次世代創薬モダリティとしてのペプチド抗がん剤の開発に挑戦し、膵がんに代表される難治がんとしてのスキルス癌治療に資する革新的なDDS製剤の合成技術の確立と実装を目指して本研究を推進していきたいと考えています。
本研究は、関西医科大学附属光免疫医学研究所腫瘍病理学近藤ラボが研究代表となり、東京科学大学物質工学院児島研究室、岡山大学医学部細胞生物学阪口研究室、久留米大学先端癌治療研究センター古賀研究室、国立がん研究センター橋渡し研究推進センター(CPOT)との共同連携で実施します。
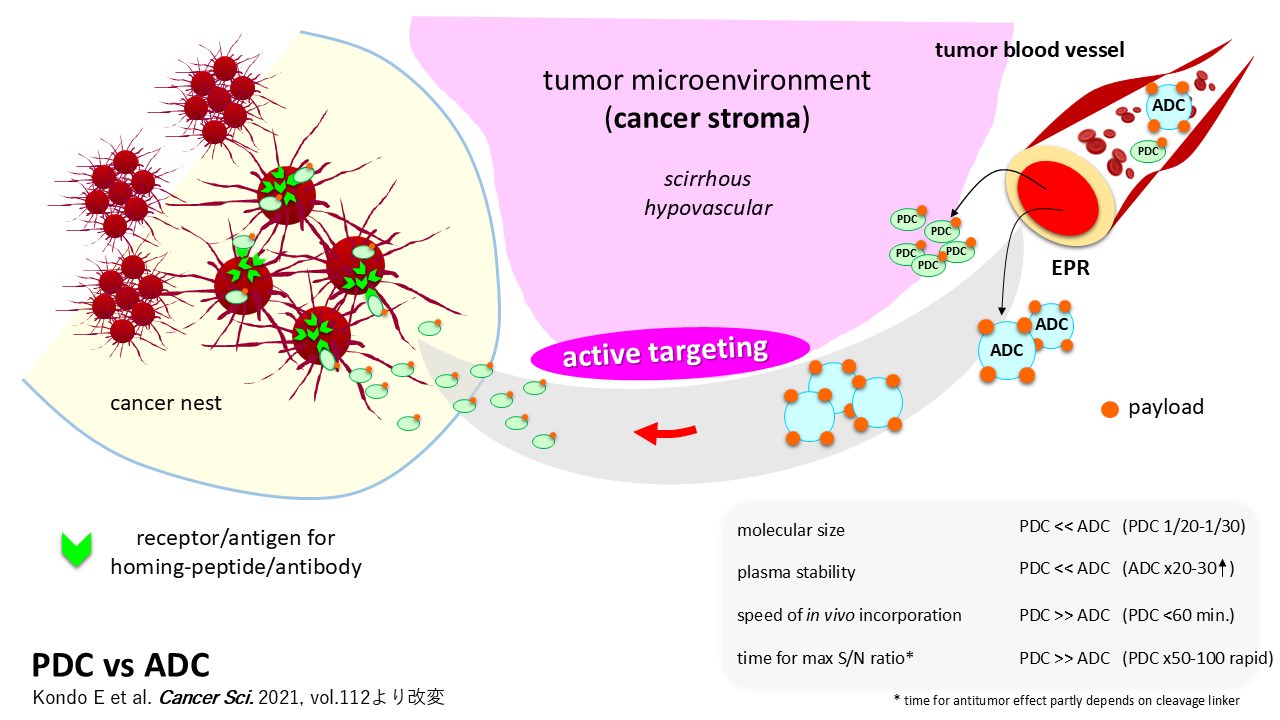
図1:ペプチド医薬(PDC)と抗体医薬(ADC)のDDS上の違い
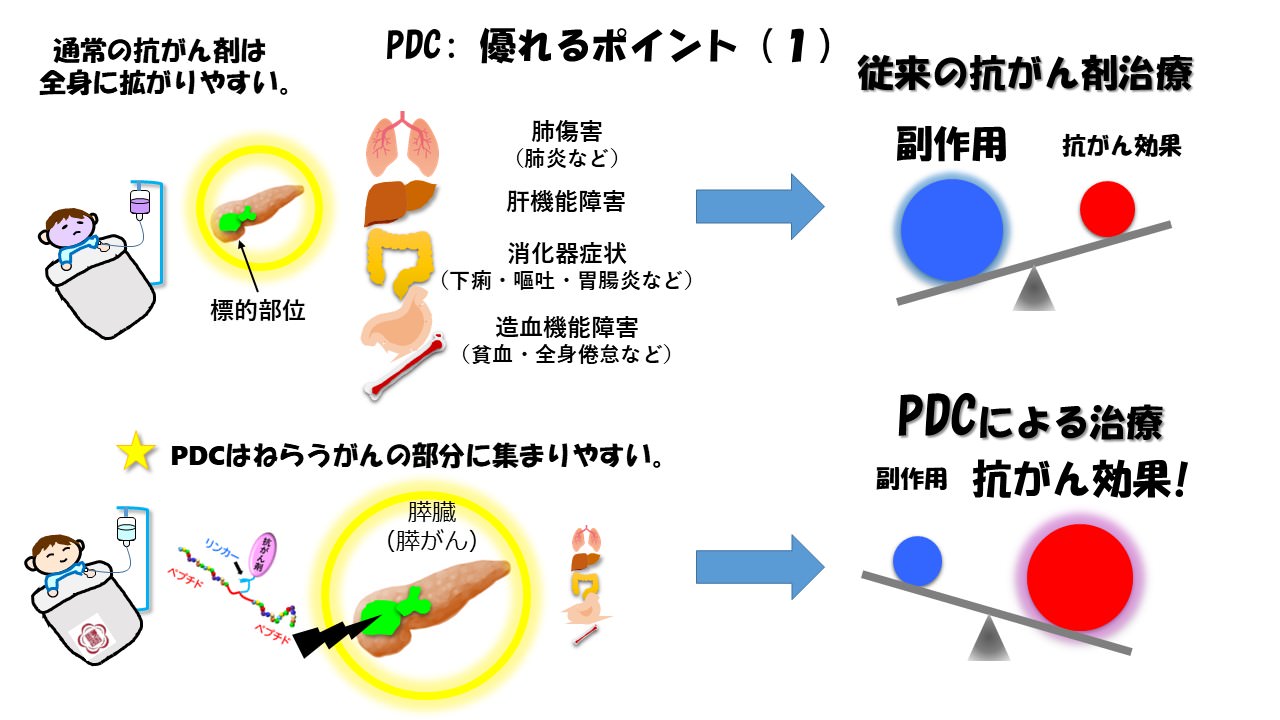
図2:ペプチド医薬(PDC)の膵がん治療における狙い
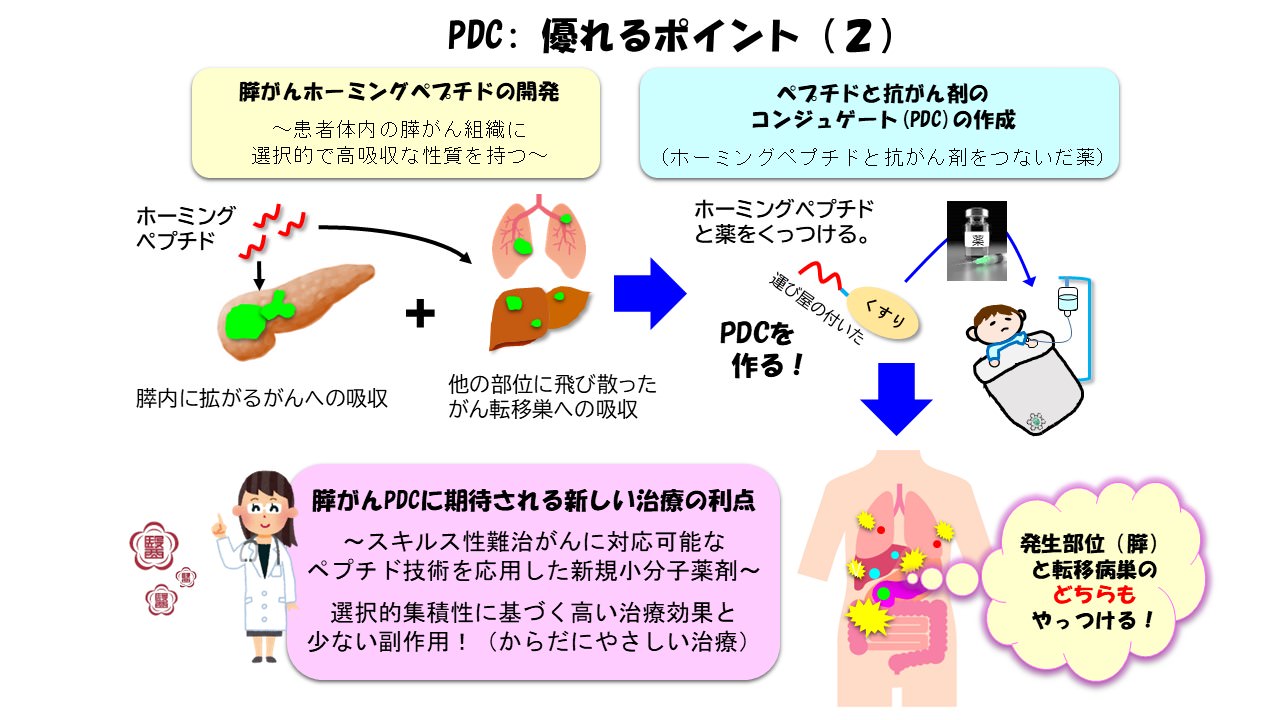
図3:ペプチド医薬(PDC)による膵がん治療の利点