採択課題
デュオカルマイシンを用いた抗体ミメティクス結合薬
研究開発代表者
金井 求
東京大学

採択課題の概要
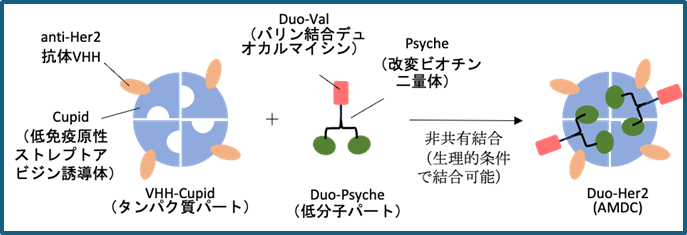
図1:AMDCの概念図(抗HER2-CupidとDuo-Psycheをモデルとして表示)
本研究では、固形進行がんの標的として重要なHER2を標的とする人工抗体VHHを用いて、極めて少数の分子でがん細胞を殺傷するデュオカルマイシン(Duo)を結合させたAMDC製剤(以下、Duo-HER2と略す)の治験の届出を目指す開発を進める(図1)。Duo-HER2は、ヒト乳がん細胞のゼノグラフトマウスで病理学的完全寛解を、重篤な副作用なしに達成したPOCのある複合製剤である。Duo-HER2は複数パートから構成される複合製剤であるため、CMC管理、薬理・毒性試験、ADME試験などについて、従来の開発方法では、極めて多額のコストと長期間の時間が必要である。
そこで、未だに治療法のない進行がんに対する新規複合製剤の開発加速化のために、以下の(1)〜(5)を目標として技術開発を進める(図2、図3)。開発体制として、アカデミックサイドは金井(東大薬)を中心とし、スタートアップサイドは抗体医薬品開発の成功経験者である土屋(CompleCure社)が率い、両者がアクセラレレーターとして、各方面の我が国を代表する専門家とスタートアップ企業の連携で、一気に加速化を進める点が特徴である。
(1)デュオカルマイシン:リンカー(アルキン)のGMP製造を見据えた合成方法の確立
(2)Psyche結合デュオカルリンカーのGMP製造を見据えた合成・精製方法の確立
(3)抗HER2-VHHとCupidの融合タンパク質のGMP製造を見据えた培養・精製方法の確立
(4)複合製剤の精製・保存法と、有効性・安全性データの取得
(5)治験に向けた根拠資料の準備と治験プロトコールの作成
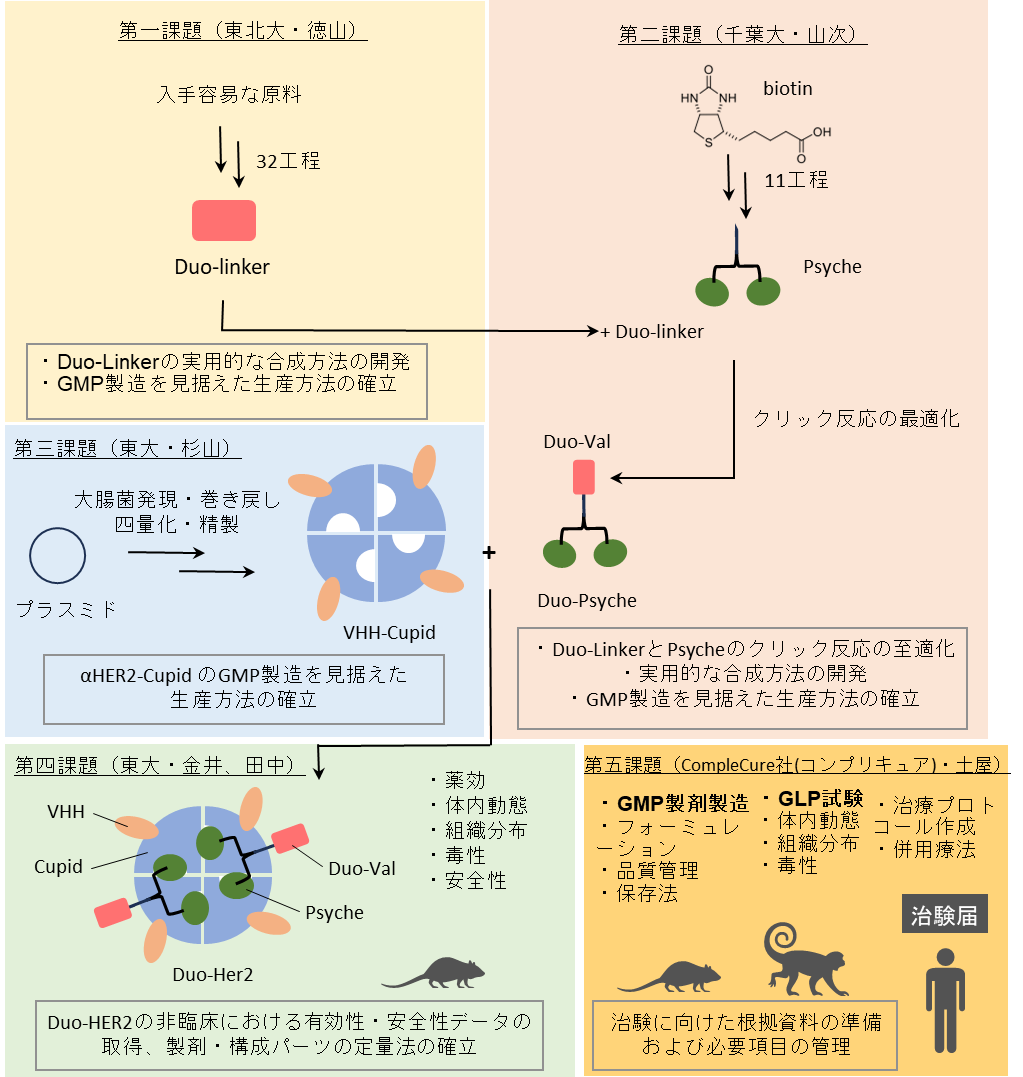
図2:実施計画:研究開発項目
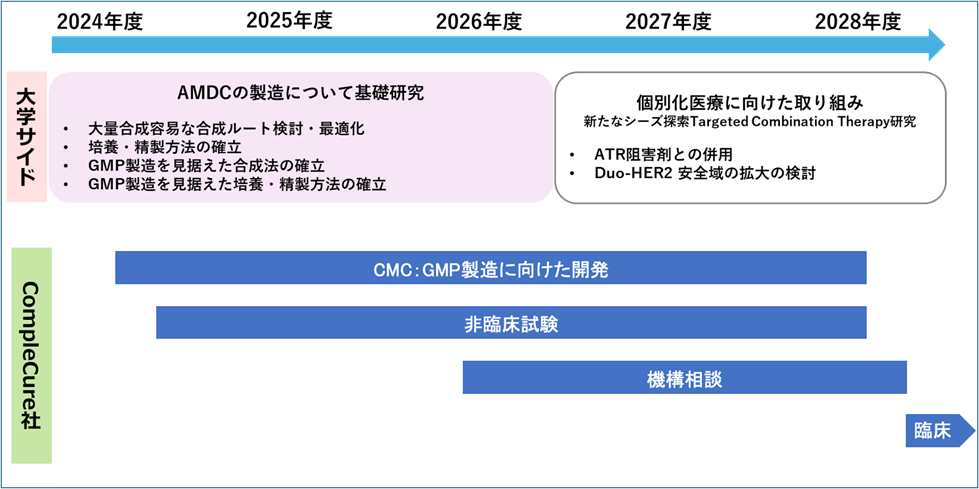
図3:開発ロードマップ
本研究は、人工設計により多数開発されつつある抗体ミメティクスと、抗がん剤、分子標的薬、光活性化物質、アイソトープなどの多様なペイロードの複合による、精密医療を目指す進行がんへの治療技術開発であり、大きな一般性、将来性、波及効果を持つ。最初のAMDC製剤としてDuo-HER2の臨床ステージアップを目指す、重要な複合技術開発の第一歩となる。
References
1) Sakata, J.; Tatsumi, T.; Sugiyama, A.; Tanaka, T.; Kanai, M.; Tokuyama, H.; Yamatsugu, K. et al. Protein Expression and Purification, 2023, 214, 106375.
2) Sugiyama, A.; Tanaka, T.; Yamatsugu, K.; Kanai, M.; Kodama, T. et al. Proc. Jpn. Acad., Ser. B. 2019, 99, 602.
3) Tatsumi, T.; Sugiyama, A.; Washiyama, K.; Yamatsugu, K.; Kanai, M. et al. Bioorg. Med. Chem. Lett. 2024, 108, 129803.
4) Yamatsugu, K.; Kanai, M.; Sugiyama, A. et al. Protein Expression and Purification, 2022, 192, 106043.
5) Kaneko, Y.; Yamatsugu, K.; Tanaka, T.; Sugiyama, A.; Kanai, M.; Katoh, H. et al Cancer Science, 2022, 113, 4350